Quantização da radioatividade
O decaimento radioativo é um processo que envolve conceitos de probabilidade. Partículas dentro de um átomo têm certas probabilidades de decair por unidade de tempo de uma maneira espontânea. A probabilidade de decaimento é independente da vida previa da partícula. Por exemplo se N(t) é considerado o número de partículas como função do tempo, então, temos a taxa de decaimento sendo proporcional a N.[5]
Formulando matematicamente temos:
A constante de proporcionalidade tem dimensão inversamente proporcional ao tempo.
onde é o número inicial de partículas. O número de partículas de um dado elemento decai exponencialmente numa taxa diretamente proporcional ao elemento. Define-se a vida média de um elemento como
Tendo um exemplo de muitas partículas, 1/e delas (cerca de 37,8%) não decairão após um tempo . Na Física Nuclear trabalha-se com o conceito de vida média, que é o tempo depois do qual a amostra se reduziu à metade.[5]
Relacionando essas duas quantidades, assim temos:
Tipos de decaimento
Quanto aos tipos de radiação, descobriu-se que um campo elétrico ou magnético podia separar as emissões em três tipos de raios. Por falta de melhores termos, os raios foram designados alfabeticamente como alfa, beta e gama, o que se mantém até hoje. Enquanto que o decaimento alfa foi apenas observado nos elementos mais pesados (número atómico 52, telúrio, e maiores), os outros dois tipos de decaimento foram observados em todos os elementos.[6]
Ao analisar-se a natureza dos produtos do decaimento, tornou-se óbvio a partir da direção das forças eletromagnéticas produzidas sobre as radiações pelos campos magnético e elétrico externos, que os raios alfa tinham carga positiva, os raios beta carga negativa, e que os raios gama eram neutros. A partir da magnitude de defleção, era claro que as partículas alfa eram muito mais maciças do que as partículas beta. Fazer passar partículas alfa através de uma janela de vidro muito fina e encerrá-las numa lâmpada de néon permitiu aos investigadores estudarem o espectro de emissão do gás resultante, e finalmente demonstrarem que as partículas alfa são núcleos de hélio. Outras experiências mostraram a semelhança entre a radiação beta clássica e os raios catódicos: são ambos fluxos de eletrões. De igual modo, descobriu-se que a radiação gama e os raios-X são formas semelhantes de radiação eletromagnética de alta-energia.[6]
Embora os decaimentos alfa, beta e gama sejam os mais comuns, outros tipos seriam descobertos. Pouco depois da descoberta do positrão em produtos de raios cósmicos, percebeu-se que o mesmo processo que opera no decaimento beta clássico pode também produzir positrões (emissão positrónica). Num processo análogo, descobriu-se que ao invés de emitirem positrões e neutrinos, alguns nuclídeos ricos em protões capturavam os seus próprios eletrões atómicos (captura eletrónica), e emitem apenas um neutrino (e geralmente também um raio gama). Cada um destes tipos de decaimento envolve a captura ou emissão de eletrões ou positrões nucleares, e leva o núcleo a aproximar-se da razão entre neutrões e protões que tem a menor energia para um dado número total de nucleões (neutrões mais protões).[6]
Pouco tempo após a descoberta do neutrão em 1932, Enrico Fermi descobriu que certas reações de decaimento raras produziam neutrões como partícula de decaimento (emissão de neutrões). A emissão protónica isolada acabaria por ser observada em alguns elementos. Foi também descoberto que alguns elementos mais pesados podem sofrer fissão espontânea resultando em produtos de composição variável. Num fenómeno chamado decaimento aglomerado, observou-se que eram emitidas ocasionalmente pelos átomos combinações específicas de neutrões e protões (núcleos atómicos), que não as partículas alfa.
Foram descobertos outros tipos de decaimento radioativo que emitiam partículas já conhecidas, mas por meio de mecanismos diferentes. Um exemplo é a conversão interna, a qual resulta na emissão eletrónica e por vezes emissão de fotões de alta-energia, embora não envolva nem decaimento beta nem decaimento gama. Este tipo de decaimento (como o decaimento gama de transição isomérica) não transmuta um elemento em outro.[6]
São conhecidos eventos raros que envolvem a combinação de dois eventos de decaimento beta com ocorrência simultânea. É admissível qualquer processo de decaimento que não viole as leis de conservação da energia ou do momento (e talvez outras leis de conservação), embora nem todos tenham sido detectados.
Leis da radioatividade
- 1ª Lei - quando um átomo emite uma partícula alfa, seu número atômico diminui de duas unidades e sua massa atômica de quatro unidades.[7]
- 2ª Lei - quando um átomo emite uma partícula beta, seu número atômico aumenta de uma unidade.[7]
As radiações gama não alteram o número atômico nem o número de massa do átomo. Quando um átomo emite uma partícula radioativa dizemos que ele sofreu uma desintegração.
1ª Lei
1ª Lei da Radioatividade ou 1ª Lei de Soddy (1ª lei da radiatividade natural) - Quando um radioisótopo emite uma partícula alfa (α) originará um novo elemento que apresenta redução de duas unidades em seu número atômico ( prótons) e redução de 4 unidades em seu número de massa (A – 4).
Por exemplo, o plutônio apresenta número de massa igual a 242 e número atômico de 94, ao emitir uma partícula alfa (α), será transmutado a urânio com número de massa igual a 238 e número atômico, 92.[8]
2ª Lei
2ª Lei da Radioatividade ou 2ª Lei de Soddy (ainda conhecida por Lei de Fajans e Russel) - Quando um radioisótopo emite uma partícula beta (β) o seu número atômico aumenta em uma unidade e o seu número de massa praticamente não sofre alteração.[9]
A desintegração de um nêutron no núcleo de um radioisótopo instável gera: um próton, uma partícula beta (β), um antineutrino, radiação gama. Por isso, o número atômico aumenta em uma unidade, já que nesse núcleo houve a formação de um novo próton.
Por exemplo, o tório apresenta massa atômica igual a 234 e número atômico, 90; ao emitir uma partícula beta (β), será transmutado a protactínio, que apresenta massa atômica igual a 234 e número atômico, 91.
Leis de Soddy e Fajans
As leis da desintegração radioativa, descritas por Soddy e Fajans, são:[10]
- Quando um átomo radioativo emite uma partícula alfa, o número de massa do átomo resultante diminui em 4 unidades e o número atômico em 2 unidades.
- Quando o átomo radioactivo emite uma partícula beta, o número de massa do átomo resultante não varia e o seu número atômico aumenta em 1 unidade.
- Quando um núcleo "excitado" emite uma radiação gama não ocorre variação no seu número de massa e número atômico, porém ocorre uma perda de uma quantidade de energia "hν".
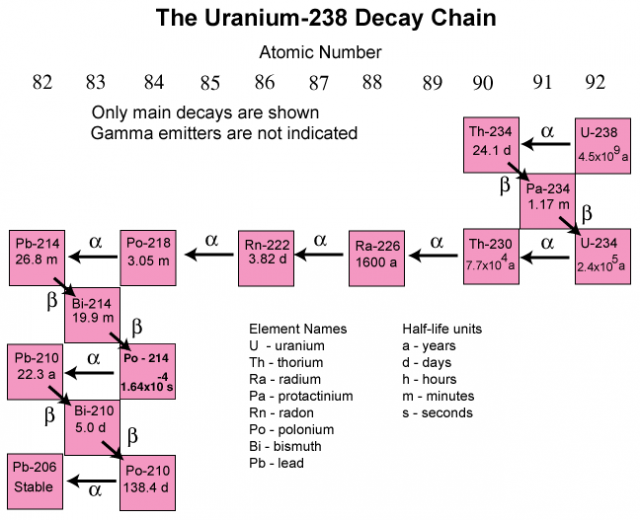
Desse modo, a emissão de partículas alfa e beta pelos átomos instáveis muda seu número atómico, transformando-os em outros elementos. O processo de desintegração nuclear só termina com a formação de átomos estáveis. O urânio-238, por exemplo, vai sofrendo decaimento até formar o elemento chumbo-206.
Decaimento radioativo como um processo estatístico
A lei de decaimento radioativo, foi deduzida a partir da suposição que decaimento radioativo num intervalo de tempo dado .[11]
A ideia é que todos os núcleos dum dado elemento químico são indistinguíveis. O melhor que se pode fazer é determinar o número médio de núcleos sofrendo decaimento no intervalo de tempo a partir de até .
Assim, o que nós temos é um processo estatístico, isto é, o decaimento dum dado núcleo é um evento aleatório possuindo uma certa probabilidade de ocorrência.
A probabilidade de decaimento por unidade de tempo por núcleo pode ser deduzida como se segue. Se nós temos N núcleos originais e o número que sofre decaimento no intervalo de tempo é , então o decrescimento relativo,
no número de núcleos por unidade de tempo, isto é, a quantidade
dá a probabilidade de decaimento por unidade de tempo por núcleo.
Esta definição concorda com o significado da constante de decaimento, .
Por definição, a constante de decaimento é a probabilidade de decaimento por unidade de tempo por unidade de núcleo.
Determinação de idade a partir da radioatividade
Esta seção não cita fontes confiáveis. (Dezembro de 2017) |
O decrescimento no número de núcleos radioativos de acordo com a lei de decaimento radioativo, pode ser usada como um meio para medir o tempo que passou desde que uma amostra contendo, inicialmente átomos radioativos e o instante quando o seu número é .
Em outras palavras, radioatividade disponibiliza uma espécie de escala de tempo. De acordo com a lei de radioatividade: o intervalo de tempo entre os instantes em que o número de núcleos radioativos é e é:
Como regra, N representa o número de núcleos não transformados no tempo presente, de modo que a equação acima dá a idade da amostra contendo os núcleos radioativos.
Nos estudos geológicos, uma escala de tempo radioativa diferente é necessária para cada aplicação. Ao determinar a idade das rochas, por exemplo, alguém deverá usar uma escala de tempo radioativa suficientemente lenta, isto é, decaimentos radioativos com meia vida da mesma ordem de grandeza que as épocas geológicas que ronda para centenas de milhões ou mesmo milhões de milhões de anos. Esta condição é satisfeita pela meia vida de e .
O urânio que ocorre naturalmente (que existe na natureza) é na verdade uma mistura de ambos. As suas meias-vidas são 4500 milhões e 900 milhões de anos, respectivamente.
No presente, o urânio quimicamente puro e ocorrendo naturalmente, contém
sendo o último o produto de decaimento radioativo de . Dado que o seu conteúdo é muito pequeno, o urânio 234 pode ser ignorado.
Cada um dos isótopos e é pai da sua própria série radioativa, ambas as quais terminam em isótopos de chumbo. Assim, núcleos de chumbo são os produtos finais do decaimento radioativo de núcleos de urânio.
Usando a razão entre urânio natural e o chumbo obtido deste, é possível determinar o intervalo de tempo durante o qual esta quantidade de chumbo se acumulou.
Na arqueologia, radioatividade é usada para determinar a idade de objetos encontrados nas escavações. Em tais aplicações, a escala de tempo de urânio não é apropriada por pelo menos duas razões:
Por uma coisa, artefatos nunca contiveram urânio. Por outra, o relógio de escala de tempo de urânio é muito lenta para a história humana onde o tempo é muitas vezes medido em séculos ou milénios. Em outras palavras, para determinar a idade de objetos arqueológicos precisa-se de escala de tempo radioativo com a meia vida de alguns séculos ou milénios. A natureza disponibilizou tal escala de tempo.
As partículas que constituem os chamados raios cósmicos primários são extremamente energéticas e, colidindo com os núcleos de elementos que formam a atmosfera da Terra, quebra-os em fragmentos. Estes fragmentos, são altamente energéticos também, e formam os chamados raios cósmicos secundários. A interação dos raios cósmicos com os núcleos do nitrogénio atmosférico transforma-os em núcleos de carbono com número de massa 14, em vez de 12, como acontece com o carbono ordinário. tem meia vida de cerca de 5570 anos o qual serve muito bem para arqueologistas. Além disso, porque a intensidade dos raios cósmicos primários permanece praticamente constante, existe um fornecimento invariável de carbono radioativo na atmosfera. O carbono radioativo produz dióxido de carbono radioativo através das plantas e cadeia alimentar, encontra o seu caminho nos animais e torna-se parte dos seus órgãos e tecidos.
Numa planta viva ou animal, a percentagem do conteúdo de carbono radioativo em comparação com o carbono ordinário não muda com o tempo, porque quaisquer perdas tornam-se boas pela alimentação. Se, contudo, a planta ou animal morre, a alimentação não pode mais substituir a perda do carbono radioativo. Assim, pode-se determinar o tempo passando desde a morte do organismo ou a idade do artifício feito de material orgânico.
Usando um contador de partículas electrizadas, foi descoberto que o carbono 14 sofre decaimento através da emissão de partículas beta que um grama de carbono radioativo contém na celulose duma árvore viva ou recentemente cortada, a atividade de um isótopo radioativo é 17,5 partículas por minuto. Isto é, a atividade de um isótopo radioativo é 17,5 decaimentos por minuto.
Convertendo, = 5570 anos em minutos, encontramos o número de núcleos de que tem este valor de atividade:
Assim, um grama de carbono na celulose duma árvore viva ou recentemente cortada contém 75 000 milhões núcleos de carbono radioativo. Este número diminui progressivamente porque não é mais substituído (e isto acontece quando a árvore é cortada), o número original decresce com o tempo. Isto é, a atividade do carbono radioativo restante irá decrescer progressivamente. Se nós compararmos a sua atividade presente à atividade que estava presente quando a madeira foi cortada, podemos determinar o intervalo de tempo entre estes dois instantes.
Quando esta técnica é aplicada em artefatos de madeira muitas vezes encontrados nas escavações arqueológicas, na verdade determina-se o tempo no qual a árvore foi cortada. Isto dá a idade do artefacto feito a partir da madeira dessa árvore.